Se cree que el ser humano es capaz de utilizar el fuego desde hace al menos un millón de años. Mucho antes, sin embargo, había conocido su poder destructor y había aprendido a salir corriendo al ver u oler la primera señal de un incendio. Este conocimiento ancestral perdura hasta nuestros días y, de hecho, aunque no veamos el incendio, nos ponemos nerviosos si vemos una gran humareda. De ahí la conocida frase popular “por el humo se sabe dónde está el fuego”.
Cuando un material se quema, se produce una reacción química entre el oxígeno y dicho material. En esta reacción el material se oxida (como si fuese hierro mojado) a mucha velocidad y en el proceso se liberan calor y gases que suben arrastrando las cenizas y formando el humo. Por tanto, el calor y el humo son una consecuencia directa del fuego, detectando los segundos podemos encontrar el primero. De hecho, el calor liberado se utiliza para descubrir y evaluar los incendios. Con cámaras infrarrojas localizadas en satélites se puede detectar en qué puntos está activo el incendio, en este caso, “por el calor se sabe dónde está el fuego”.

Imagen de Reinald Kirchner [CC BY-SA 2.0 ()] (Creative Commons)
Las combustiones no son un caso aislado, en las reacciones químicas es muy habitual que se produzca intercambio de calor; algunas de estas reacciones liberan calor (como una combustión) y otras, por el contrario, lo absorben. Este calor liberado o absorbido se puede medir y cuantificar y, de manera similar a los incendios, aportar mucha información sobre el proceso que lo ha originado.
Existe un tipo de reacción química particular en la que dos moléculas se unen para formar un complejo, es decir, pasan de ser moléculas aisladas moviéndose libremente en una disolución a agruparse y formar una asociación estable. Y, por supuesto, en esta reacción también se libera o absorbe calor (aunque menos que en una combustión). Estas reacciones son de especial interés para muchas investigaciones biológicas. Pueden explicar, por ejemplo, los mecanismos de acción de patógenos, como virus o bacterias; o qué fármacos son efectivos contra una enfermedad particular. La cantidad de calor que aparece en estas reacciones suele ser pequeño y para medirlo hace falta un aparato especial con una sensibilidad muy alta, capaz de detectar cambios de temperatura de centésimas de grado. Como este aparato mide calor, entra dentro de la categoría de calorímetros. Y este en concreto se denomina calorímetro de titulación isotérmica o ITC por sus siglas en inglés.
En un ITC encontramos dos compartimentos: un compartimento aislado, en el que solo hay agua y en el que “no va pasar nada” y otro compartimento de medida en el que se van a mezclar las dos moléculas y se va a registra el calor que se origina por la unión. En el compartimento de medida se añade una cierta cantidad de la molécula A disuelta en agua y se introduce una aguja que va a ir inyectando pequeñas cantidades de la molécula B (denominada normalmente ligando ya que se une o “liga” a la molécula A). En cada inyección, las moléculas de B se van a unir a las de A que queden libres y en ese proceso se desprende o absorbe un cierto calor que se registra. Dicho calor se mide siempre en referencia al compartimento en el que solo hay agua y en el que, por lo tanto, no va a haber ninguna reacción química.
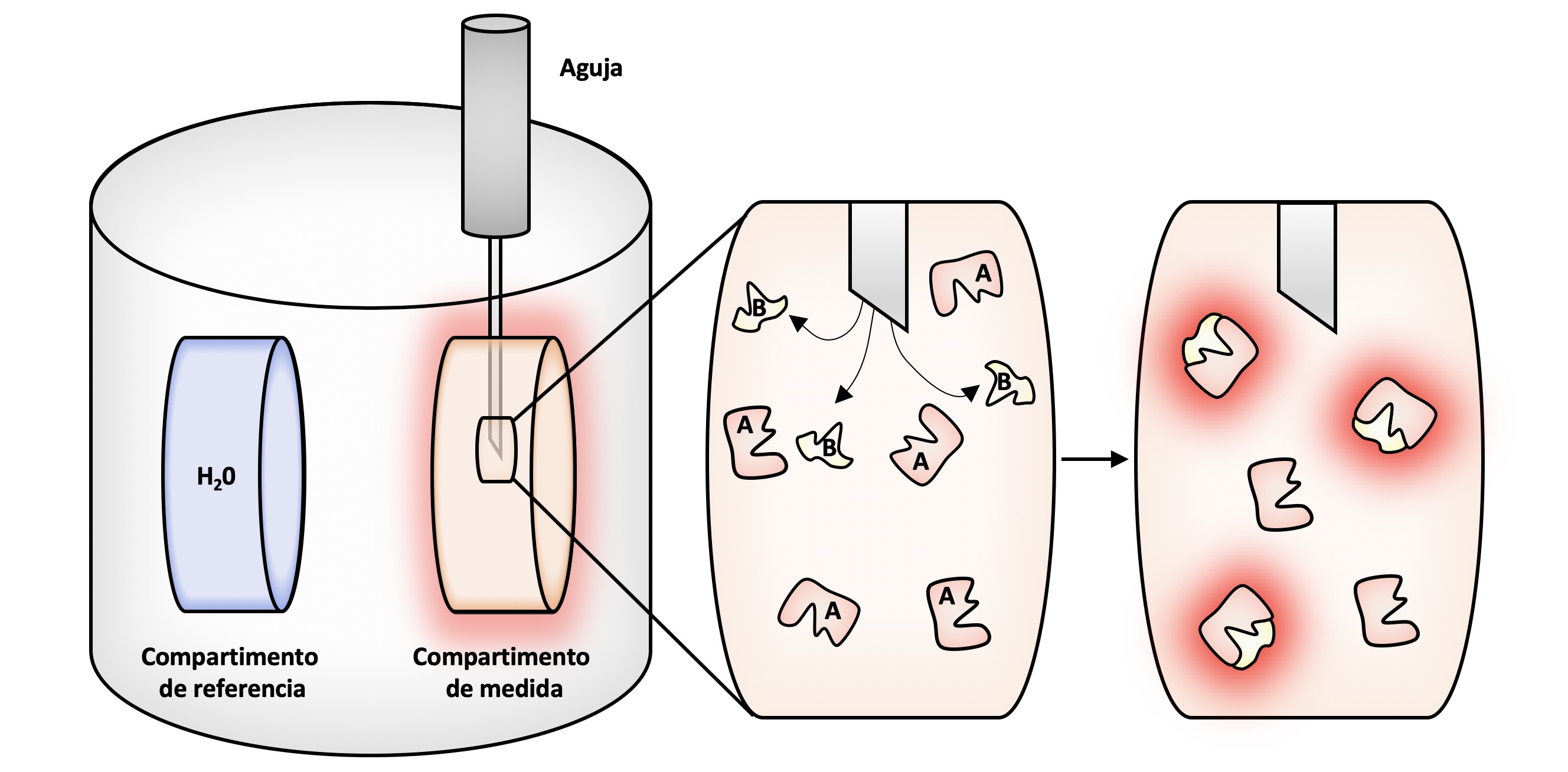
Esquema de Moisés Maestro López
Tras cada inyección de B, quedarán menos moléculas de A libres hasta que al final ya no quede ninguna (se dice que se ha saturado). Entonces se analizan todos los datos obtenidos y se obtienen diferentes características de la reacción: la afinidad (la tendencia que tienen las moléculas A y B de formar el complejo), el calor liberado en cada reacción o la proporción de A y B en el complejo. Esta proporción podría ser de 1 molécula de A y 1 de B, que es lo más sencillo, pero podría haber otras combinaciones, por ejemplo, de una molécula de A y tres de B o cualquier otra proporción.
Toda esta información es muy útil para entender procesos biológicos y para, llegado el caso, alterarlos con fines terapéuticos. Por ejemplo, si se están buscando nuevos fármacos que se unan a alguna parte concreta de la célula, la información obtenida podría decirnos si nuestro nuevo medicamento se une mejor que el que se usa actualmente. Y todo este conocimiento ayuda a diseñar fármacos más específicos y bajar, por tanto, la dosis terapéutica.
Como conclusión, las reacciones en las que se forman complejos, y que ocurren a escala microscópica en el interior de nuestras células, son difíciles de investigar. No obstante, podemos desentrañarlas midiendo algunas de sus consecuencias, en este caso el calor. Al final, es el mismo principio de “por el humo (o el calor) sabemos dónde está el fuego (o cualquier otra reacción química)”.
