“Es cosa sabida que la vida es una sucesión de procesos químicos ejecutados en su mayor parte por un grupo de moléculas biológicas llamadas proteínas, cuya forma se ha adecuado a su función. Esta última noción, la de la forma -estructura- de las proteínas, que ahora damos por sentado, se estableció después de una serie de desarrollos conceptuales y tecnológicos que son hijos de la revolución que se produjo en la física a principios del siglo XX. Este nuevo libro describe la evolución de las ideas, de los avances científicos que las moldearon, así como de las personas detrás de las ideas y de los desarrollos tecnológicos".
La vida es un complejo entramado de miles de reacciones químicas que se producen en paralelo, se suceden unas a otras y se controlan entre ellas. En la mayor parte de esas reacciones tanto los agentes como los sustratos sobre los que actúan son proteínas, de tal manera que sin mucha exageración podemos decir que los seres vivos están formados por una sopa -el agua es absolutamente imprescindible para que se produzca la vida- de proteínas.
Este libro se ocupa de contar el proceso de caracterización de las proteínas, que se inició durante la Ilustración -aunque entonces no se llamaban así- y que se benefició fundamentalmente de dos grandes revoluciones: la de la química, acaecida fundamentalmente en el siglo XIX, y la de la física moderna, surgida en los albores del siglo XX. La primera revolución sirvió para determinar que las proteínas están formadas por la sucesión lineal y en distintas proporciones, de 20 moléculas con un núcleo similar, pero propiedades ligeramente distintas. Estas moléculas son los aminoácidos y son de las primeras moléculas que aparecen cuando en el laboratorio se intenta imitar las condiciones que dieron lugar a la vida. La segunda revolución es si cabe más interesante, pues ha permitido descubrir las fuerzas de carácter débil que hacen que esa secuencia lineal de aminoácidos adquiera en el espacio tridimensional una forma -una estructura- única para cada secuencia de aminoácidos. Es esta forma la que da a lugar la función, y este es uno de los grandes descubrimientos en el mundo de las proteínas, la relación directa entre secuencia lineal de aminoácidos, forma y función.
La misma revolución en la física que dio lugar a la caracterización de esas fuerzas suministró un gran número de técnicas -difracción de rayos X, resonancia magnética nuclear y microscopía electrónica, entre las más influyentes- que han permitido determinar la estructura de las proteínas -de miles de ellas- y ha dejado claro en el proceso que las proteínas adquieren esa forma en parte gracias a pequeños “andamios” -las hélices a, las láminas b-. Esas y otras técnicas han permitido descubrir que muchas proteínas se unen entre sí para formar, de manera estable o transitoria, complejos proteicos que hacen que las funciones que ejecutan sobre un determinado sustrato lo sean a la manera de una línea de ensamblaje, de forma secuencial y controlada en el tiempo y en el espacio. La figura de la línea de ensamblaje sirve para comprender mejor otro de los conceptos que ha cristalizado en los últimos años, la consideración de muchas proteínas como pequeñas máquinas -nanomáquinas- que realizan un trabajo sobre sus sustratos. Este trabajo ha podido ser llevado a cabo mediante una serie de técnicas que han ido estableciéndose desde finales del siglo XX, provenientes también de los inagotables recursos del mundo de la física. Estas técnicas, que se denominan de molécula única, permiten el manejo -literal- de una sola molécula, a diferencia de los experimentos en los que se mide un cierto parámetro a la vez sobre trillones de a la vez moléculas -las que puede haber en el pequeño volumen de un tubo de ensayo-, ocultándose en el promediado ciertos comportamientos específicos de estas nanomáquinas.
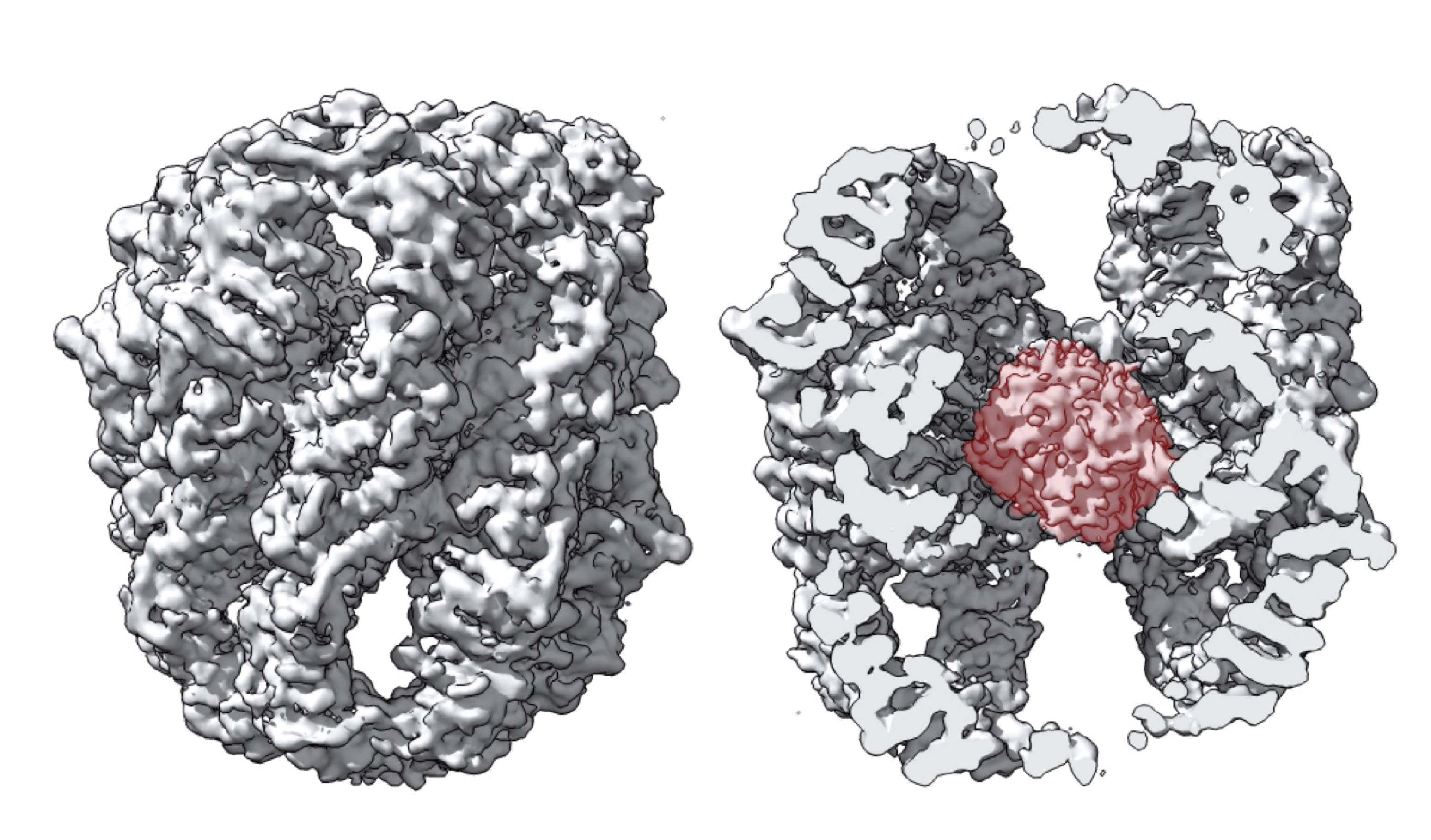
Reconstrucción en 3D de la chaperona CCT. En rojo aparece la proteína mLST8, que establece contactos con varias subunidades de la chaperona. Jorge Cuéllar, José María Valpuesta,CNB-CSIC
La mayor parte de las proteínas se disponen en un medio acuoso -aunque esta definición es quizás excesiva dadas las altas concentraciones de proteína en la célula, que debiéramos definir mejor como grumo- pero un porcentaje nada desdeñable interacciona de distintas maneras con las membranas y deben adaptarse a esas condiciones. El estudio de estas proteínas, junto con aquéllas que no poseen una estructura organizada y que tienen un papel muy importante en la formación de estructuras no membranosas, son dos de las últimas fronteras en el estudio de las proteínas, que se ha beneficiado en los últimos años del desarrollo de técnicas de computación que están generando resultados impensables hasta hace poco.
Finalmente, la física no sólo ha proporcionado un arsenal de técnicas al estudio de las proteínas, sino que ha suministrado un importante componente humano: los físicos. Estos han dado una visión nueva a viejos problemas de la biología, fundamentalmente a una rama muy activa y que se ha alimentado en gran medida del estudio de las proteínas, la llamada biología estructural. Esta hija de la biología y la física se ha beneficiado como pocas disciplinas del triángulo formado por las ideas y el desarrollo de tecnologías, que se retroalimentan, y de los científicos que han promovido ambas.
“Proteínas. Los asombrosos ladrillos de la vida”
José María Valpuesta
Editorial Guadalmazán
ISBN 978-84-17547-46-2 (2021)
