El ser humano siempre ha luchado por ser capaz de visualizar y comprender muchos procesos biológicos imperceptibles por nuestros sentidos, invisibles para el ojo humano. La curiosidad y el interés en descubrir la manera de llegar a ese mundo inexplorado, lo ha llevado a la creación de los microscopios.
Un paso muy importante en esta lucha de ver lo imperceptible a simple vista se consiguió a mediados del siglo XX, con la aparición de los microscopios electrónicos capaces de producir imágenes más ampliadas, mejoradas y precisas que las que ofrecían los clásicos microscopios ópticos que siempre se habían utilizado para el estudio de muestras biológicas.
Mientras que los microscopios ópticos utilizan la luz visible o haz de fotones, esa pequeña región del espectro electromagnético cuyas longitudes de ondas son perceptibles por el ojo humano, un microscopio electrónico utiliza como fuente de iluminación un haz de electrones. Gracias a la longitud de onda más corta del haz de electrones, se puede alcanzar una alta resolución, por lo que es posible producir imágenes muy detalladas de partículas minúsculas y visualizar bacterias, protozoos, algunas algas como las diatomeas y hongos como las levaduras, virus, o regiones específicas de las células, virus y bacterias, e incluso pequeñas moléculas como proteínas.
Esa pequeña pero a la vez enorme diferencia entre ambos tipos de microscopio ha llevado al desarrollo de la biología estructural, gracias a la cual los investigadores son capaces de observar agentes microscópicos causantes de enfermedades infecciosas en humanos como, por ejemplo, el virus Zika o el propio coronavirus SARS-CoV-2 causante de la COVID-19. Asimismo, con este tipo de microscopios se ha conseguido determinar la estructura tridimensional de biomoléculas como las proteínas responsables de la resistencia a los antibióticos.
Como curiosidad, uno de los virus que ayudó a impulsar el desarrollo de este tipo de instrumentación fue la investigación del virus causante de la poliomielitis, un virus que es capaz de invadir nuestro sistema nervioso central y, en cuestión de horas, puede producir una parálisis muscular irreversible.
Observar lo nunca antes visto por la comunidad científica
A la alta resolución de dichos microscopios electrónicos se le suma la criomicroscopía electrónica, una de las técnicas más importantes a la hora de resolver las estructuras de biomoléculas y en el desarrollo de nuevos fármacos. Dicha técnica consiste en vitrificar las muestras biológicas, o lo que es lo mismo, congelarlas ultrarrápido a temperaturas por debajo de los - 180 grados centígrados. Para ello se utiliza nitrógeno líquido, capaz de congelar a tal velocidad que las muestras biológicas se mantengan hidratadas y conserven su forma natural, permitiendo a los investigadores visualizar miles de procesos nuevos nunca antes vistos por la comunidad científica.

Imagen panorámica de la sala de los criomicroscopios electrónicos del CNB-CSIC (Javier Chichón, Servicio de CrioEM, CNB-CSIC)
La criomicroscopía electrónica se dio a conocer al mundo entero gracias a los premios que otorga todos los años la Real Academia de las Ciencias de Suecia a aquellas personas que hayan hecho excelentes investigaciones: Los Premios Nobel. En el año 2017, los investigadores Joachim Frank, Jacques Dubochet y Richard Henderson consiguieron el premio nobel de la Química gracias al desarrollo de la criomicroscopía electrónica, una técnica que combina el proceso de vitrificar las muestras biológicas con su observación en microscopio electrónico.
Gracias al diseño de dicha instrumentación, capaz de incluso mantener la muestra congelada durante horas o días, se está consiguiendo observar objetos invisibles para el ojo humano, con gran precisión. Por ejemplo, se podría observar sistemas biológicos formados por varios elementos como las proteínas de membrana u otros complejos macromoleculares e incluso, contemplar cómo entra un virus a una célula.
¿Tenemos acceso a criomicroscopios de última generación en España?
A pesar de que la criomicroscopía electrónica sea una técnica innovadora y esencial para el avance de la ciencia, su elevado coste de adquisición, mantenimiento y la necesidad de disponer de un personal cualificado para su adecuado manejo son requerimientos de los que no disponen todos los centros de investigación. Por ese motivo, es importante fomentar la colaboración con distintos proyectos científicos públicos y privados y avanzar en muchos proyectos de investigación.
En el Centro Nacional de Biotecnología (CNB-CSIC) tenemos el privilegio de disponer de uno de los criomicroscopios más avanzados para el estudio detallado de muestras biológicas, pero no es el único, existen otros tres criomicroscopios electrónicos en el servicio de criomicroscopía electrónica cuyo uso está al servicio de grupos de investigación españoles y europeos través de iniciativas como iNEXT y la red INSTRUCT-ERIC de la Unión Europea. Este servicio cuenta con personal técnico altamente especializado que proporciona apoyo experimental para la optimización de los resultados.
¿Qué se ha descubierto mediante criomicroscopía electrónica en el CNB-CSIC?
Los nuevos equipos permiten recopilar grandes cantidades de datos de alta resolución y procesar las imágenes con detalles cada vez más precisos como, por ejemplo, las estructuras internas de virus, bacterias y células.
Entre los ejemplos recientes de las aplicaciones de la criomicroscopia en el CNB cabe destacar el trabajo realizado por el grupo de la Dra. Carmen San Martín en colaboración con el Instituto Pasteur en Francia, quienes han conseguido resolver la estructura de un adenovirus que infecta a lagartos, observando una importante diferencia en las proteínas de superficie de sus cápsides, a pesar de la cual conservan una estructura concreta esencial para la supervivencia de ambos virus.
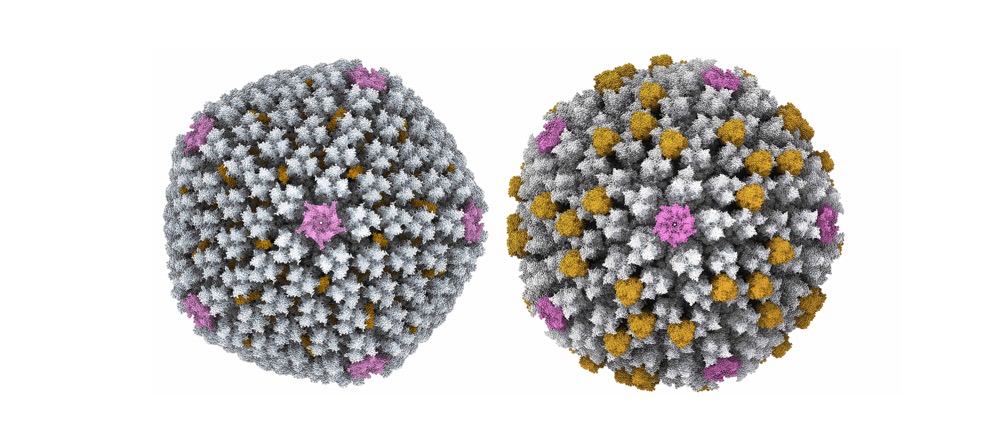
Imagen detallada de las cápsides de un adenovirus humano (izquierda) y de un lagarto (derecha) utilizando criomicroscopía electrónica
(laboratorio de Carmen San Martín, CNB-CSIC).
El trabajo realizado por el grupo de la Dra. Cristina Risco, utilizando técnicas de criomicroscopía y análisis de imágenes, han conseguido resolver el mecanismo de salida del reovirus humano, un patógeno responsable de enfermedades respiratorias y digestivas en niños y jóvenes. Esta información es de gran utilidad para la identificación de los factores celulares y virales que participan en esta nueva ruta de salida viral y el diseño de nuevos fármacos antivirales que, además, actúen sobre virus de distintas familias.
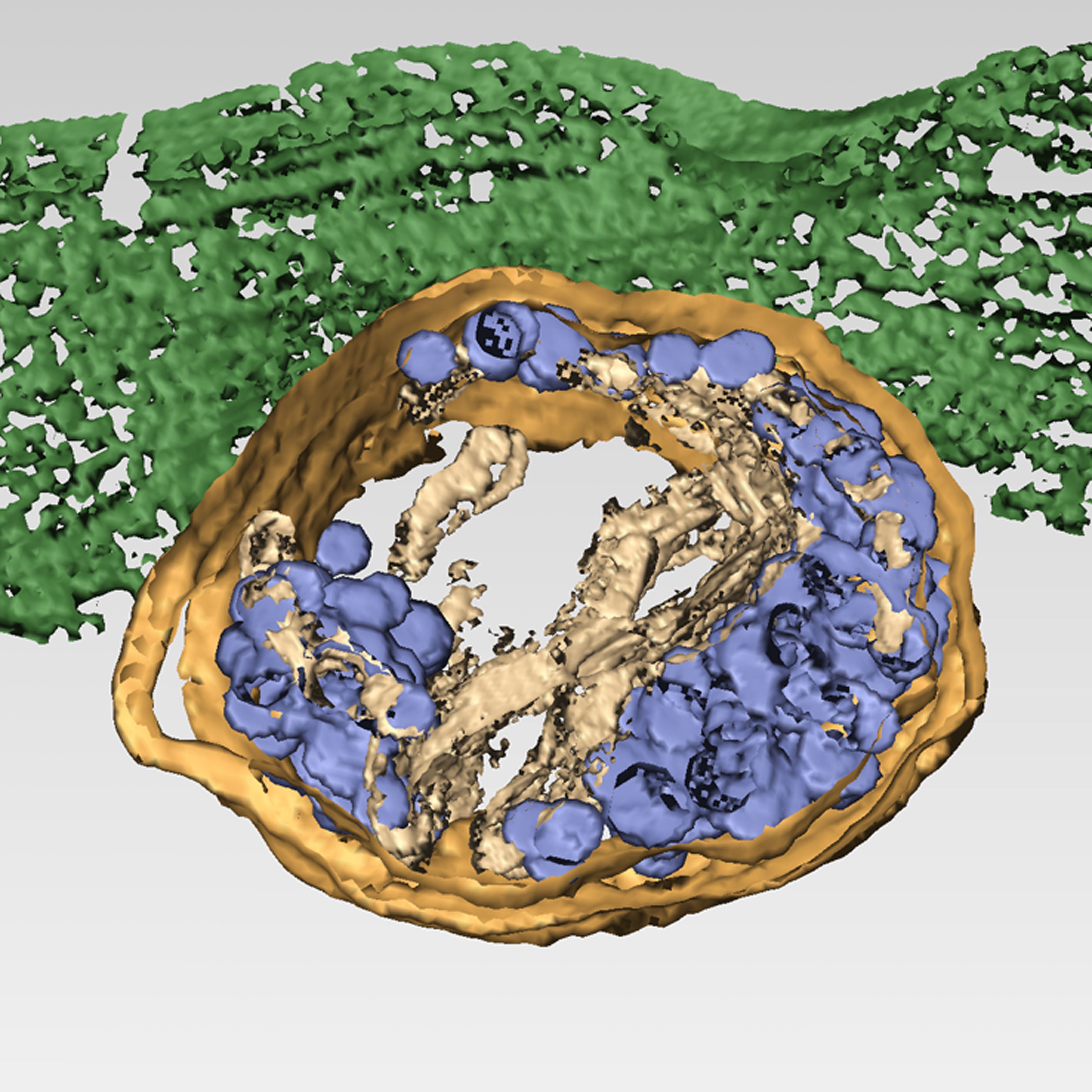
Tomografía electrónica tridimensional de una célula infectada por el reovirus humano
(Laboratorio de Cristina Risco, CNB-CSIC)
Dirigidos a la determinación de estructuras de complejos de proteínas cabe destacar el trabajo del grupo dirigido por el Dr. Valpuesta en colaboración con el equipo liderado por el investigador Barry Willardson de la Universidad Brigham Young (Utah, Estados Unidos), quienes han logrado determinar el mecanismo de funcionamiento de una de las chaperonas moleculares (proteínas que están involucradas en el plegamiento de otras proteínas) más importantes en organismos eucariotas (el complejo CCT).
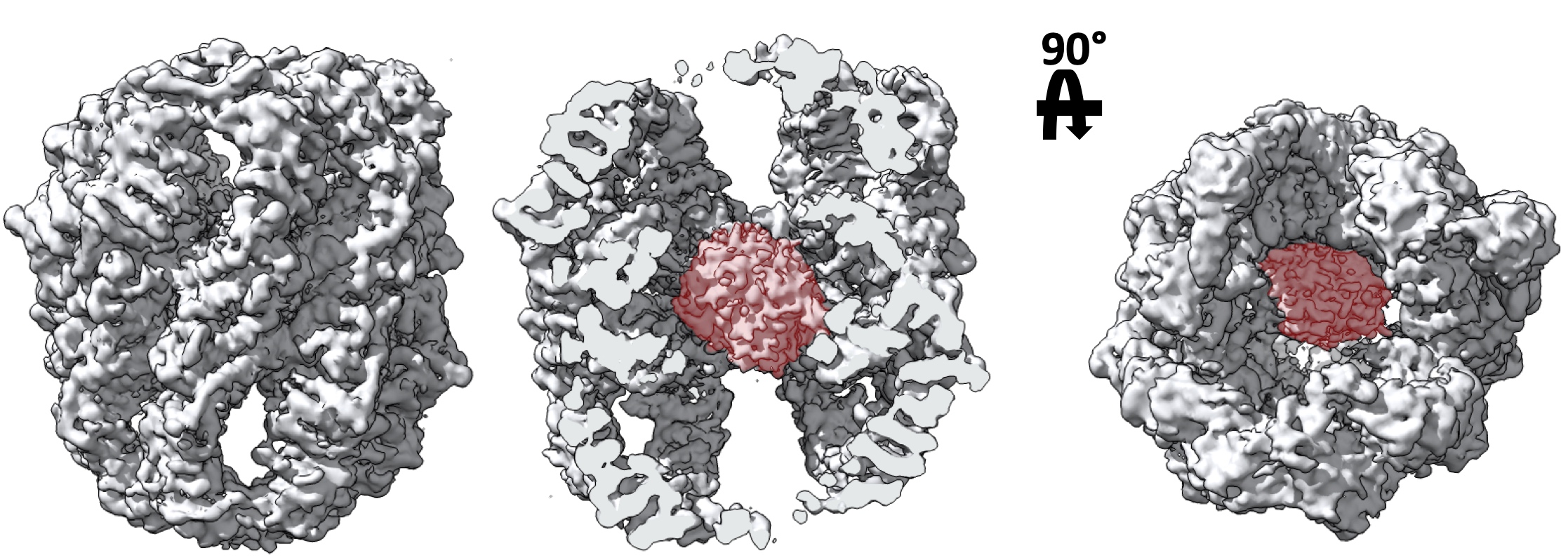
Estructura por criomicroscopía electrónica de la chaperona molecular CCT (laboratorio de José María Valpuesta, CNB-CSIC)
Otras de las estructuras atómicas conseguidas mediante la criomicroscopía electrónica es la de la proteína no estructural 1 (nsP1) del virus chikungunya realizado por el equipo de Juan Reguera en la Universidad de Aix-Marsella (AMU) en colaboración con el CNB. Esta proteína ayuda a la localización de los sitios de replicación viral dentro de las membranas celulares y al camuflaje del material genético del virus como, ARNs celulares, para evitar su degradación por sistemas de control celulares y la expansión del virus.
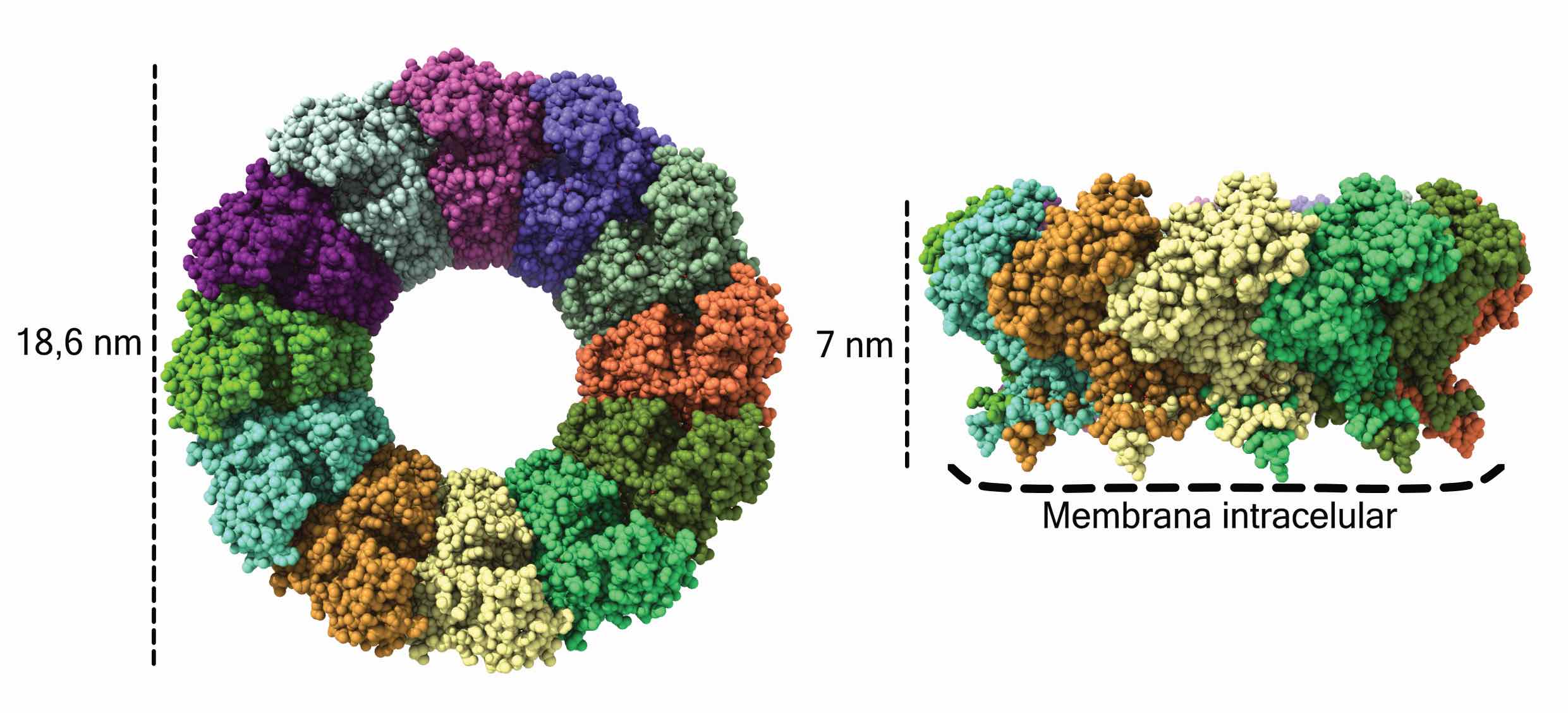
Estructura atómica de la proteína nsP1 del virus Chikungunya
(Laboratorio de Juan Reguera, CNRS-Universidad de Aix-Marsella (AMU).
Todos estos ejemplos muestran que los avances científicos van ligados al desarrollo de tecnología cada vez más avanzada. Los nuevos criomicroscopíos de barrido o confocales permiten realizar microscopía correlativa, donde se complementan los datos obtenidos en diferentes microscopios para llegar a niveles de detalles que incluyen el seguimiento de procesos biológicos complejos.
